研究プロジェクト
遠位胆管癌の病態解明に向けた多施設共同研究
遠位(中・下部)胆管に発生する胆管癌はその病態が明らかではありません。専門施設でも総計100例程度の経験しかないことが主な理由です。遠位胆管癌の今後の臨床研究を考えるにあたり、病態解明が最優先事項と考えました。多施設共同(後方視)研究とし、データの質にこだわり症例集積を継続しています。われわれの目標は、本研究を通じて、有益な臨床知見を世界に届けることです。
具体的な研究内容とその臨床展開をまとめます。①リンパ節転移の至適分類法:N分類の修正につながりました。②術前減黄の手技と長期予後に影響:術前減黄手技に一石を投じました。③治癒切除後の再発様式と再発の危険因子:術後補助化学療法の選択に有用です。これらはすでに完了し、次の検討課題として、④遠位胆管癌における門脈切除再建、⑤深部浸潤長に基づく新たなT分類の可能性、⑥縮小手術の胆管切除の意義、などに取り組む予定です。
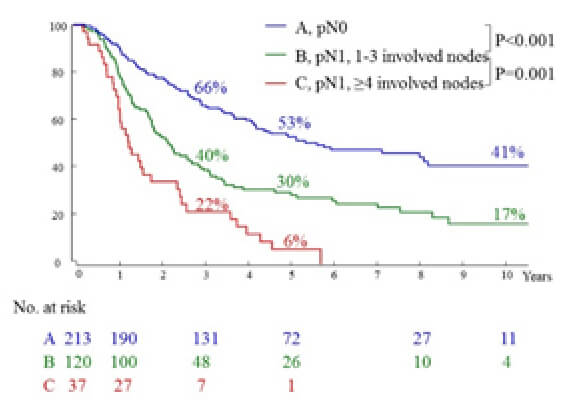
リンパ節転移個数別の長期予後
リンパ節転移は転移個数で1-3個と4個以上に分けると予後の層別化に有用である。
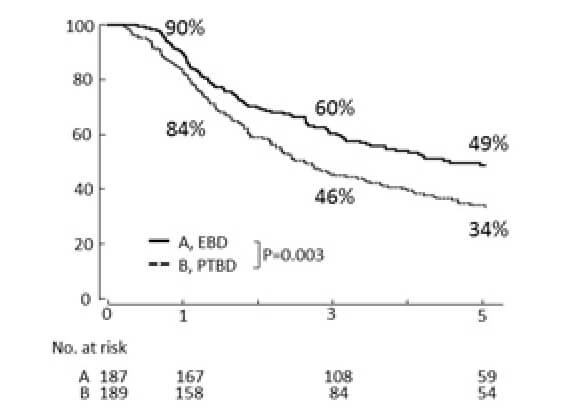
術前胆道ドレナージの方法と長期予後と関係
経皮的ドレナージ(PTBD)は内視鏡的ドレナージ(EBD)よりも長期予後を悪化させる。その理由は、腹膜播種(含瘻孔再発)を増加させることによる。
肝虚血再灌流に伴う肝障害抑制に関する研究
肝臓は血液の流れが非常に豊富な臓器です。したがって肝臓を切除する場合には、出血をできるだけ抑えるために肝臓への血流を完全に遮断する必要があります。しかしこの手技は術後に肝障害をもたらします。われわれはこの肝虚血再灌流後肝障害をできるだけ軽減する方法について研究を行っています。下図はその一例ですが、肝臓への血流を遮断する前に栄養素として重要な分岐鎖アミノ酸(BCAA)を投与すると、肝臓の血流が改善されて肝障害が抑制されることが生体顕微鏡で確認されました(下図)。またそのメカニズムとしてBCAAのクッパー細胞活性化抑制作用が関与していることを解明しました。これ以外にも様々な薬剤で肝障害を抑制する可能性を模索しております。
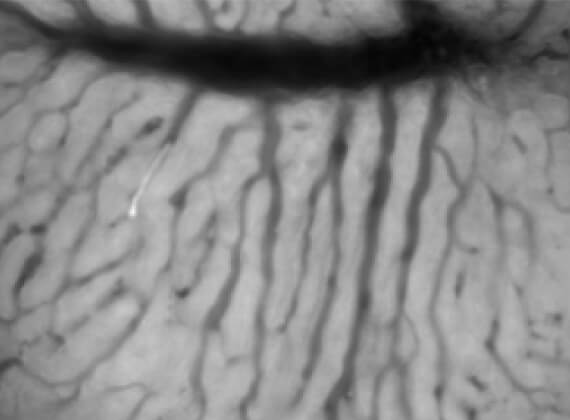
ラット肝虚血再灌流後の類洞血流。蛍光で標識した赤血球を追跡することにより類洞内の血流速を測定することができる。
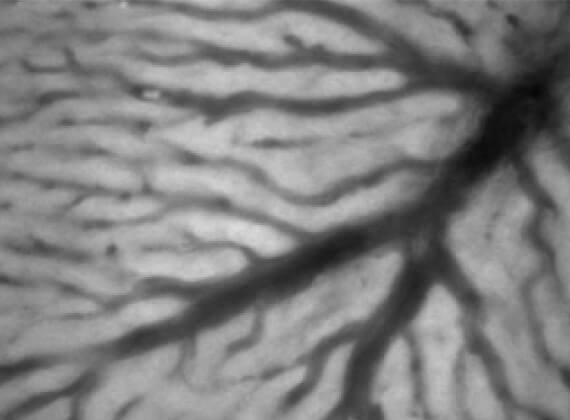
肝虚血再灌流前にBCAAを投与したラットでの類洞血流 類洞径がより太く、BCAA非投与群よりも良好な血流が維持されていることが確認された。これに伴い、術後の肝酵素上昇も有意に抑制されていた。
われわれの研究室では上記以外にも大量肝切除モデル、胆管結紮モデル、胆管炎モデル、敗血症モデルなどの様々な動物モデルを用いて肝臓に関する生理学的研究を行い、臨床の現場に少しでも役立つ成果を上げるよう努力しています。
胆道再建を伴う肝切除術後の周術期抗菌薬投与に関する前向き検討
胆道再建を伴う肝切除は手術侵襲が大きく,術後感染性合併症発症率が高いが,抗菌薬予防投与の至適投与期間についての報告はなく,各施設で経験に頼った投与を行っているのが現状です.術前胆道ドレナージ後に胆道再建を伴う肝切除を施行した86例を対象として,無作為に,術後2日間抗菌薬を投与する群と術後4日間投与する群に振り分け,患者背景,術後感染性合併症発症や術後炎症反応を前向きに,比較検討した.End Pointは術後5日目のSIRS反応,副次項目は術後30日以内のSSIや感染性合併症発症としました.結果は患者背景,術後感染性合併症発症や術後炎症反応(SIRS),そして術後に抗菌薬を追加投与した症例数も有意差は認めませんでした.胆道再建を伴う肝切除術後に対する抗菌薬予防投与期間は術後2日投与でもSIRS反応,感染性合併症増加を認めず,術後2日投与で問題ないと考えました.今後はこの結果を当科で施行している他の手術にも応用できないか検討していく予定です.
表 術後感染性合併症(2日投与群vs4日投与群)
← 横にスクロールしてご覧ください →
| 2-day(n=43) | 4-day(n=43) | P | |
|---|---|---|---|
| 感染性合併症総数 | 13 (30.2%) | 14 (32.6%) | 0.816 |
| Surgical site infections (SSI) | 8 (18.6%) | 10 (23.3%) | 0.596 |
| Superficial / deep incisional SSI | 2 (4.7%) | 0 | 0.152 |
| Organ / space SSI | 7 (16.3%) | 10 (23.3%) | 0.417 |
| Remote infections (RI) | 7 (16.3%) | 6 (14.0%) | 0.763 |
| 胆管炎 | 6 (14.0%) | 3 (7.0%) | 0.291 |
| 腸炎 | 1 (2.3%) | 3 (7.0%) | 0.306 |
| 肺炎 | 0 | 0 | ー |
| 敗血症 | 2 (4.7%) | 1 (2.3%) | 0.557 |
| Clavien grade ≧3a以上の合併症 | 23 (53.5%) | 29 (67.4%) | 0.186 |
| 死亡率 | 0 | 0 | ー |
| 術後在院日数 | 25 (13-46)* | 27 (13-83)* | 0.089 |
肝胆膵悪性腫瘍における癌抑制遺伝子TFF(Trefoil Factor Family)の役割についての研究
TFFは障害を受けた胃粘膜の修復に必要な遺伝子ですが、最近では胃癌抑制遺伝子としての役割が注目されています。一方、このTFFは膵前癌病変であるpanIN (Pancreatic Intraepithelial Neoplasms)やIPMN (Intraductal Papillary Mucinous Neoplasms)に豊富に発現しており、膵発癌に密接にも関与していることが示唆されています。われわれは遺伝子改変マウスモデルを用いることで、TFFが膵の発癌を抑制していることを発見しました。今後はこのマウスモデルを用いて膵癌の発癌機構を解明し、またTFFを用いた新たな進行膵癌治療戦略の開発や、TFF1による膵癌発生予防(chemoprevention)の可能性を探ることを目的とし、研究を続けています。
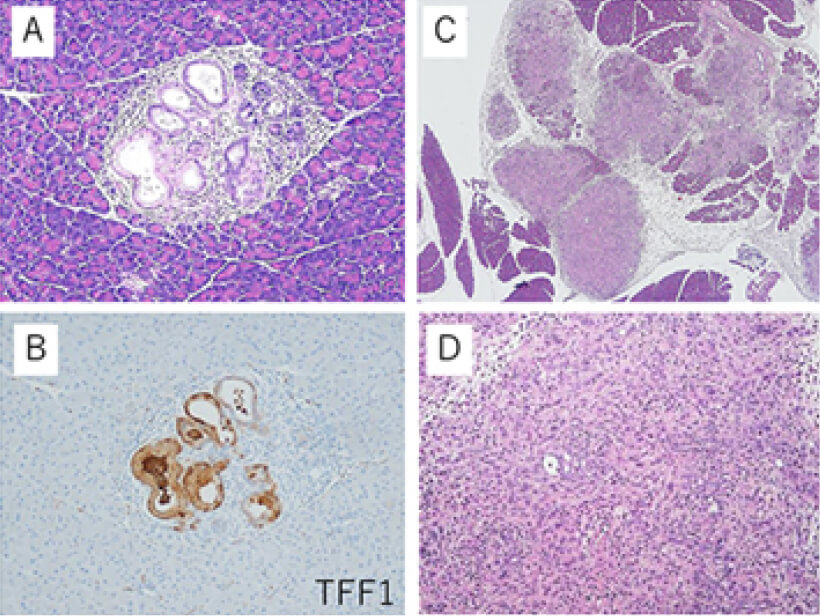
KC (Pdx1-Cre/LSL-KRASG12D)マウスおよび
KC/TFF1KOマウスの膵像組織像
(A・B)KCに発生したPanIN
(C・D)KC/TFF1KOに発生した膵癌
癌に対する核酸医薬開発
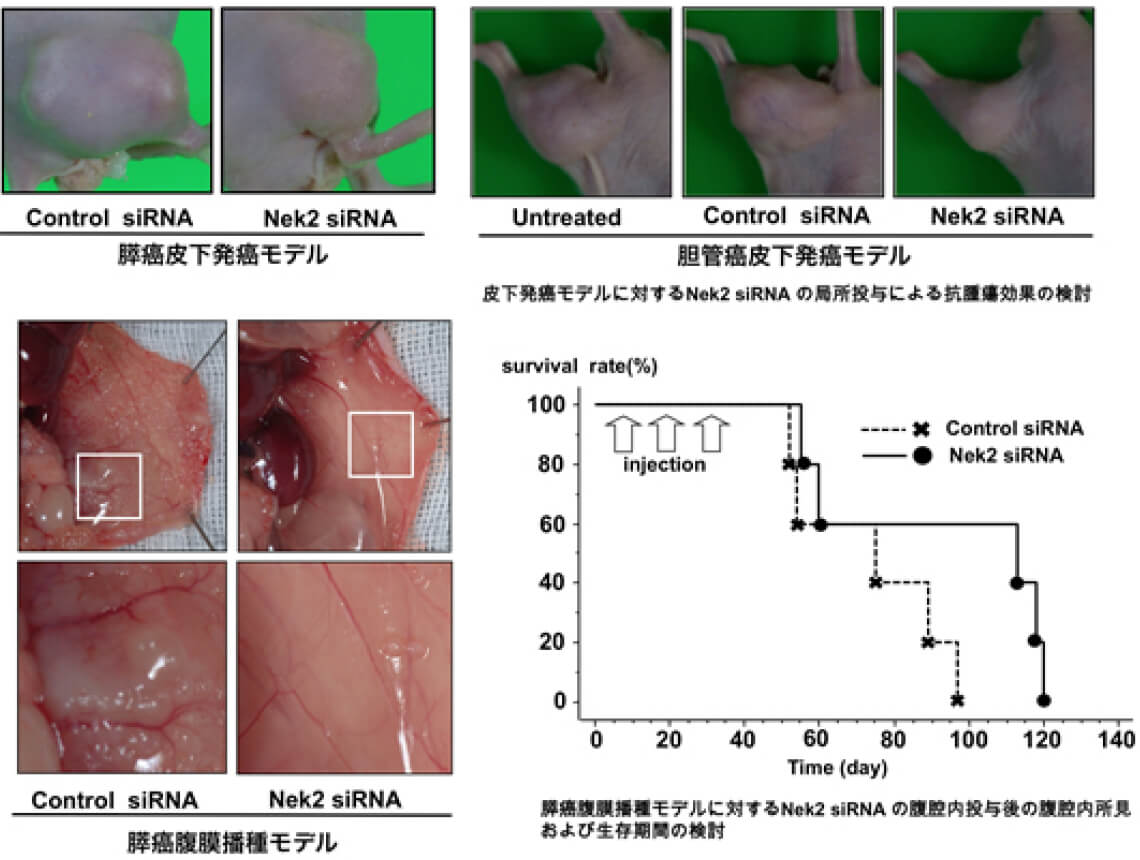
Nek2 (NIMA related kinase 2)はセリンスレオニンキナーゼであり、細胞分裂や染色体の分配との関連が報告されている。われわれはNek2を標的にしたsiRNAによる核酸医薬の開発を行っており、胆管癌、膵癌、乳癌、大腸癌など様々な癌でのNek2の発現亢進を報告している。Nek2 siRNAはこれらの癌細胞株において増殖を抑制し、細胞死を誘導した。またNek2 siRNAはマウス皮下発癌モデルにおいて腫瘍増殖を抑制し、マウス腹膜播種モデルにおいて生存期間を延長した。2013年6月よりfirst in humanであるNek2 siRNA 臨床試験「膵癌切除不能患者に対するNek2 siRNA局注療法の安全性及び有効性に関する研究」を実施している。Nek2 siRNAの有効性に関しては更なる検討が必要ではあるが、Nek2 siRNAが癌に対する新規治療法になると考えている。
α-ビサボロールによる新規癌治療法の開発
α-ビサボロールは天然に存在する単環式セスキテルペノイドの一種であり,カモミールやサルビアなどにおける精油成分である.抗炎症作用,抗菌作用,胃保護作用,抗酸化作用などを有している。われわれは,α-ビサボロールの抗腫瘍効果についての研究を行なっている。α-ビサボロール膵癌細胞株において増殖を抑制させ、細胞死を誘導させるだけでなく、浸潤および運動能も抑制させることを報告している。またα-ビサボロールはマウス皮下発癌モデルにおいて腫瘍の増殖抑制効果を示し、癌抑制遺伝子の一つであるEGR1(early growth response-1)の関与を明らかにしている。膵癌に対する新規治療法として、臨床応用するためには更なる作用機序が必要ではあるが、α-ビサボロールは膵癌に対する新規抗癌剤となる可能性があると考えている。

脂肪幹細胞シートを用いた周術期合併症に対する予防治療法の開発
脂肪幹細胞は脂肪組織由来の多機能細胞であり、分化能と再性能を有している。これまで、われわれは脂肪幹細胞が肝切除術後の肝再生に有効であることを報告している。現在、磁気による組織工学技術を用いた脂肪幹細胞シートを作製し、膵液瘻治療への応用を研究している。ラットの膵液瘻モデルにおいて、脂肪幹細胞シートの膵切除後の貼付は未治療の場合と比較して、腹腔内の鹸化や癒着を減弱させ、アミラーゼおよびリパーゼも減少させた。脂肪幹細胞シートは膵液瘻の予防に有効であり、膵液瘻を含めた周術期合併症への臨床応用が可能と考えている。

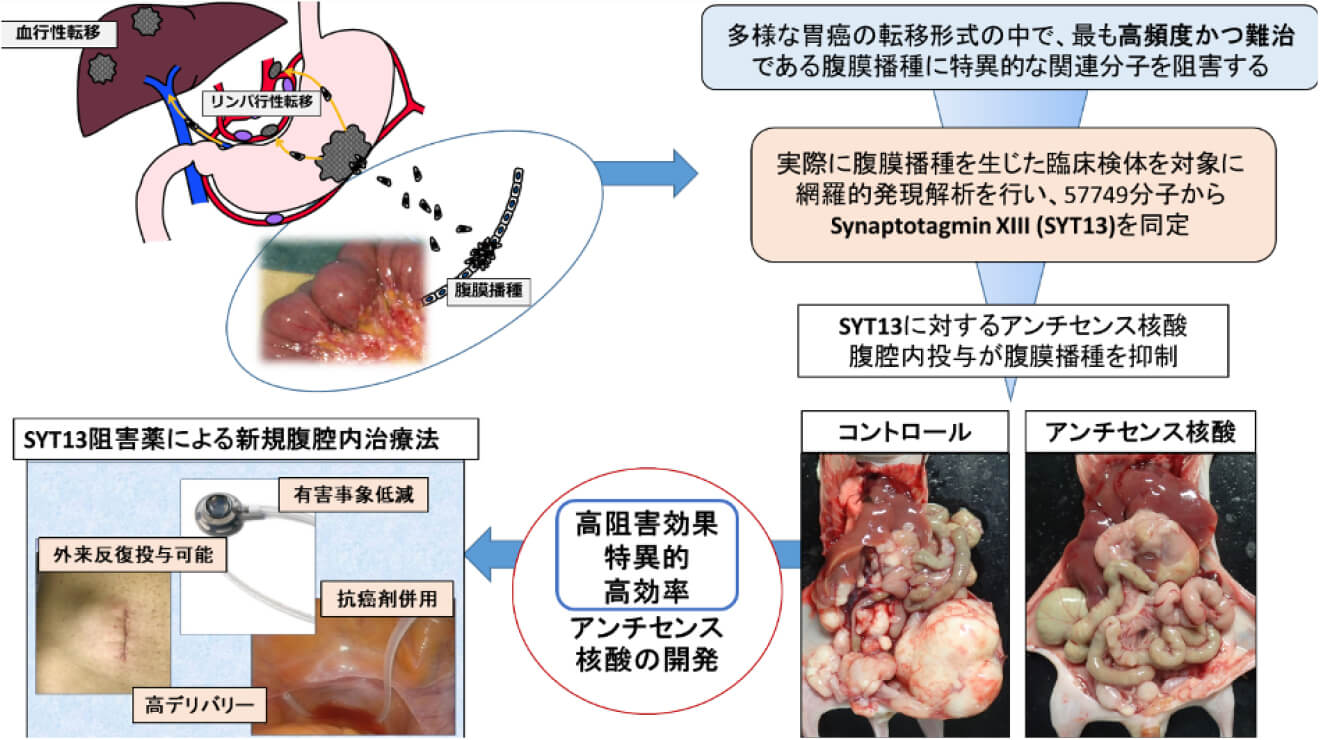
新規胃癌腹膜播種特異的分子標的治療薬の開発
腹膜播種は胃癌で高頻度かつ難治な転移再発様式です。当教室では、腹膜播種形成に特異的に関与する新規分子を同定し、これを標的とした腹腔内治療の開発を目指しています。非臨床安全性試験の段階にいたっており、第I相臨床試験の準備中です。
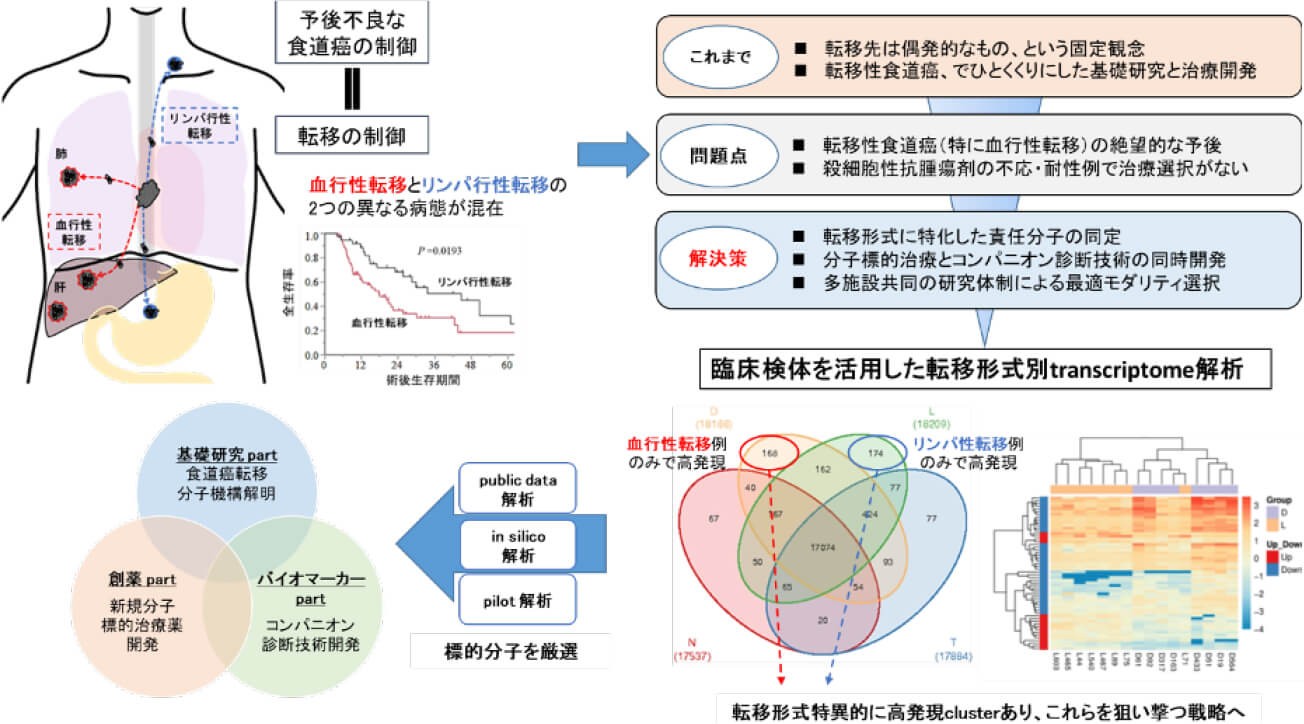
転移形式別Transcriptome解析による胃癌肝転移特異的バイオマーカーの研究
肝転移に代表する胃癌の血行性転移は多くの分子が関与する多段階の過程を経て形成されることが知られていますが、その中には転移経路に特異的な分子が存在すると考えています。そこで、肝転移・再発をきたした症例に特異的に発現異常を認める分子を網羅的発現解析から同定し、その胃癌肝転移診断・予測バイオマーカーとしての有用性を研究しています。
新規血清がんマーカー開発のための国際共同前向き研究
大規模検診でのスクリーニング、がん診断、治療方針決定のための進行度診断、治療の効果判定、切除術後の再発モニタリングのいずれの場面においても、非侵襲的かつ簡便に採取可能な血清がんマーカーが切望されています。当科では独自に発見した血清マーカーに対する測定キットを構築し、これを検証するための韓国・米国との国際共同前向き研究を行っています。
進行胃癌術前化学療法の効果予測バイオマーカー開発研究
血液検体、組織検体を用いたマルチオミクスデータをAI解析することで、高性能かつ新規性の高い進行胃癌術前化学療法の効果予測バイオマーカー同定を試みています。
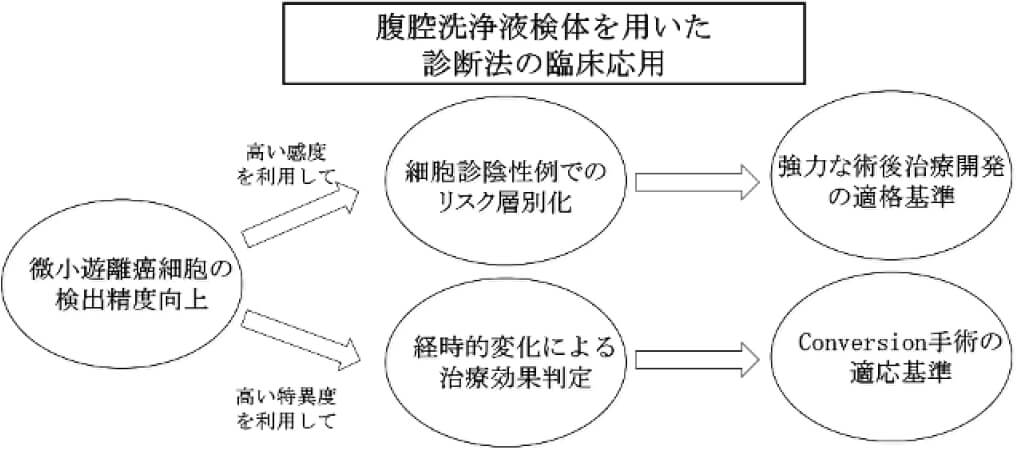
胃癌腹腔洗浄液検体を用いた腹膜播種予測と腹膜播種治療効果判定の分子マーカー開発
胃癌腹腔洗浄液検体を用いた腹膜播種予測と腹膜播種治療効果判定の分子マーカー開発を行っています。
食道癌転移臓器嗜好性の分子病態解明
食道癌転移臓器嗜好性の分子病態解明を行っています。